 |
| ||||||
| |||||||
| / Обзоры и публикации |
Апоптоз, опосредованный рецептором смертиРецептор смерти (DR Death receptor) является членом надсемейства рецепторов фактора некроза опухоли (TNFR Tumor necrosis factor receptor) с внеклеточным цис-богатым доменом и внутриклеточным доменом смерти (DD death domain). Когда рецептор смерти соединяется со специфическим лигандом смерти, он получает внеклеточный сигнал и активирует механизм апоптоза в клетках, индуцируя апоптоз. Основными известными на сегодняшний день лигандами смерти являются Fas (APO-1, CD95) - FasL (CD95L), TNFR1 (DR1) - TNF, TRAILR1 (DR4) - TRAIL (APO-2L), TRAILR2 (DR5) - TRAIL (APO-2L), DR3 (APO-3, TRAMP) - TL1A и т.д. В настоящее время существует 3 основных сигнальных пути апоптотических рецепторов смерти: Fas, TNFR1, TRAIL.
Пути, по которым белок caspase8 активирует Caspase3, варьируются в разных типах клеток. В клетках I типа комплекс DISC активирует большое количество Caspase8, Caspase8 активирует Caspase3, а Caspase3 действует на различные субстраты, вызывающие апоптоз. В клетках II типа активируется только небольшое количество Caspase8. Активная Caspase 8 может стимулировать трансформацию Bid в tBid, который затем перемещается на митохондриальную мембрану, активируя проапоптотические факторы семейства Bcl-2 и ингибируя антиапоптотические факторы семейства Bcl-2, которые опосредуют апоптоз через митохондриальный путь. Кроме того, Daxx с доменом DD Fas, также может активировать сигнальный путь JNK и усиливать транскрипционную экспрессию проапоптотических генов, таких как p53, Fas и FasL, через митохондриальный путь для опосредования апоптоза.
Сигнальный путь TNFR1
FADD recruits and activates pro-caspase8 through DED to form active Caspase8 after binding to adapter protein TRADD. Caspase8 triggers Caspase cascade to mediate apoptosis, while FADD also can recruit FLIP to inhibit the release of active Caspase8. When the adapter protein TRADD binds to RIP by DD, it activates the TNFR related factor (TRAF-2) which binds to TRAF-1 and recruit cIAPs, the formed complex inhibits the activity and release of Caspase8, and thereby inhibiting apoptosis. In addition, TRAF-2 can activate NF-κB-inducing kinase (NIK), which in turn activates IκB kinase (IKK) through phosphorylation. IKK phosphorylates IκB and releases NF-κB, then translocates to the nucleus and activates anti-apoptotic genes such as cIAP, FLIP, Bcl-XL expression, and promote cell survival.
Сигнальный путь TRAIL
|
|
|
© ООО «Лабораторная Диагностика» info@LD.ru тел.: +7 495 369-20-43 |
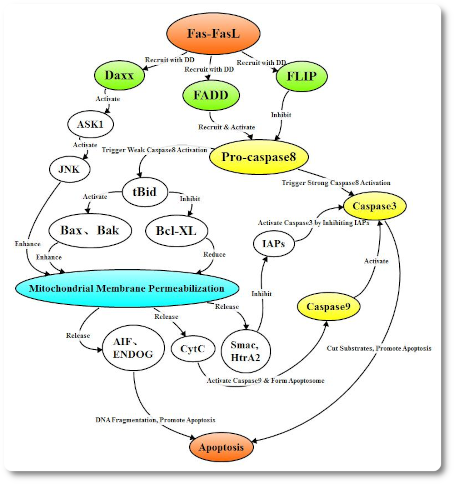 Когда комплекс FasL связывается с Fas, инициируется Fas-FasL-опосредованный апоптоз внешнего пути рецептора смерти. В процессе сигнальной трансдукции 3 молекулы рецептора Fas объединяются с лигандом с образованием тримера и кластеризованный внутриклеточный рецептор смерти рекрутирует FADD, Daxx, FAP-1, FLIP и другие связанные белки. FADD набирает про-каспазу 8 через эффекторный домен смерти (death effector domain DED) с образованием индуцирующего смерть сигнального комплекса (DISC), а про-каспаза8 в DISC саморасщепляется в активную Caspase 8. FLIP содержит DED, который позволяет интегрировать его в DISC рецептора смерти; FLIP, в свою очередь, ингибирует активацию про-каспазы 8 путем конкурентного связывания DED на FADD или DED на Caspase8.
Когда комплекс FasL связывается с Fas, инициируется Fas-FasL-опосредованный апоптоз внешнего пути рецептора смерти. В процессе сигнальной трансдукции 3 молекулы рецептора Fas объединяются с лигандом с образованием тримера и кластеризованный внутриклеточный рецептор смерти рекрутирует FADD, Daxx, FAP-1, FLIP и другие связанные белки. FADD набирает про-каспазу 8 через эффекторный домен смерти (death effector domain DED) с образованием индуцирующего смерть сигнального комплекса (DISC), а про-каспаза8 в DISC саморасщепляется в активную Caspase 8. FLIP содержит DED, который позволяет интегрировать его в DISC рецептора смерти; FLIP, в свою очередь, ингибирует активацию про-каспазы 8 путем конкурентного связывания DED на FADD или DED на Caspase8.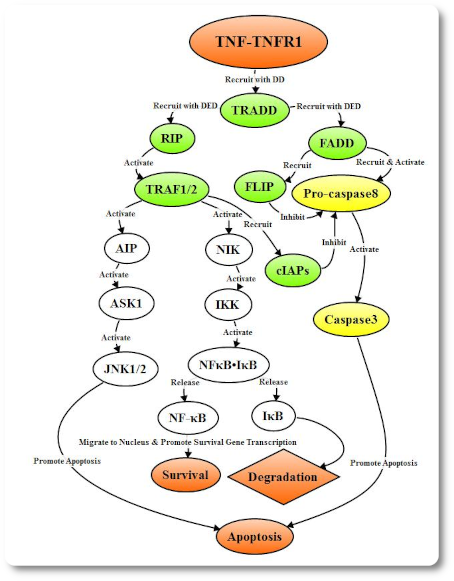 Тример TNF связывается с TNFR1, чтобы индуцировать кластеризацию DD TNFR1 для рекрутирования переходного белка TRADD, который набирает сигнальные молекулы, такие как TRAF2, RIP и FADD. TRAF2 и RIP могут активировать сигнальные пути NF-κB и JNK / AP, в то время как FADD запускает каскад каспазы.
Тример TNF связывается с TNFR1, чтобы индуцировать кластеризацию DD TNFR1 для рекрутирования переходного белка TRADD, который набирает сигнальные молекулы, такие как TRAF2, RIP и FADD. TRAF2 и RIP могут активировать сигнальные пути NF-κB и JNK / AP, в то время как FADD запускает каскад каспазы.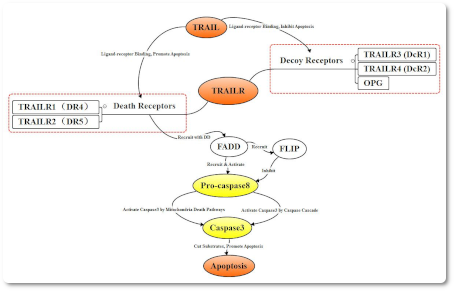 TRAIL является трансмембранным белком типа II. На сегодняшний день обнаружено не менее 5 TRAIL рецепторов TRAILR1 (DR4), TRAILR2 (DR5), TRAILR3 (DcR1), TRAILR4 (DcR2), OPG. Рецепторы TRAIL можно разделить на две категории, одна из которых - рецепторы приманки, такие как TRAILR3, TRAILR4, OPG, а другая - рецепторы смерти, такие как TRAILR1, TRAILR2. При сочетании с лигандом TRAIL они могут образовывать нефункциональные комплексы и блокировать апоптоз. Экспрессия TRAILR1 и TRAILR2 была значительно увеличена в раковых клетках после связывания с лигандом TRAIL, про-каспаза 8 была рекрутирована комбинацией DD и FADD с образованием DISC, про-caspase 8 в DISC саморасщепляется в активную Caspase 8, которая опосредует апоптоз путем активации Caspase 3 через путь Caspase, похожий на Fas, и митохондриально-зависимый путь.
TRAIL является трансмембранным белком типа II. На сегодняшний день обнаружено не менее 5 TRAIL рецепторов TRAILR1 (DR4), TRAILR2 (DR5), TRAILR3 (DcR1), TRAILR4 (DcR2), OPG. Рецепторы TRAIL можно разделить на две категории, одна из которых - рецепторы приманки, такие как TRAILR3, TRAILR4, OPG, а другая - рецепторы смерти, такие как TRAILR1, TRAILR2. При сочетании с лигандом TRAIL они могут образовывать нефункциональные комплексы и блокировать апоптоз. Экспрессия TRAILR1 и TRAILR2 была значительно увеличена в раковых клетках после связывания с лигандом TRAIL, про-каспаза 8 была рекрутирована комбинацией DD и FADD с образованием DISC, про-caspase 8 в DISC саморасщепляется в активную Caspase 8, которая опосредует апоптоз путем активации Caspase 3 через путь Caspase, похожий на Fas, и митохондриально-зависимый путь.